内镜黏膜下剥离术(ESD)是目前治疗胃肠道早癌及癌前病变的新型微创方法,可达到与外科手术一样的效果,它是指在内镜下使用高频电刀与专用器械,将胃肠道病灶(包括胃肠道早期肿瘤)与其下方正常的黏膜下层逐步剥离,以达到将病灶完整切除的目的。

一、ESD的优点
ESD是一项先进的内镜技术,可以实现对胃肠道表浅病变的治愈性切除,在避免外科手术及保留器官的同时,对病灶进行切缘阴性的整块切除。
与传统的内镜下黏膜切除术(EMR)相比,它的优点在于可以对直径大于2cm的病灶进行整块切除,避免分片切除,进而避免局部复发。
整块切除病灶后可以对其进行组织病理学分析,以确定是否是治愈性切除。
不管表浅病灶大小、位置及是否存在纤维化,ESD均可对其切除,但是上述优点是以穿孔、出血等风险增加及手术时间较长为代价的。
它具有以下优点:
1.创伤小、不改变消化道结构、避免外科手术风险及减少术后生活质量下降等;
2.患者可接受多个部位多次治疗;
3.使医生获得完整的组织病理标本以供分析;
4.对于面积较大且形态不规则或合并溃疡、瘢痕的肿瘤进行96%以上的切除率,以减小复发概率。
5.在疗效评估上非常乐观,据相关研究显示:
- 胃早癌可实现较高的整块切除率(92%~97%)和完整切除率(73.6%~94.7%),5年总生存率和5年疾病生存率分别为96.2%~97.1%和100%。
-
- 食管ESD的整块切除率和完整切除率分别为90%~100%和87.9%~97.4%;病变局限于上皮或黏膜固有层者以及病变浸润深度超过黏膜固有层者,在接受ESD治疗后的5年生存率分别为100%和85%。
-
- 结直肠ESD的整块切除率和治愈性切除率分别为82.8%和75.5%。
总之,ESD是一种经济、安全、可靠的治疗消化道浅表性病变的方法。

二、ESD的适应证
1.消化道巨大平坦息肉
直径大于2 cm的胃肠道宽基息肉和无蒂息肉。
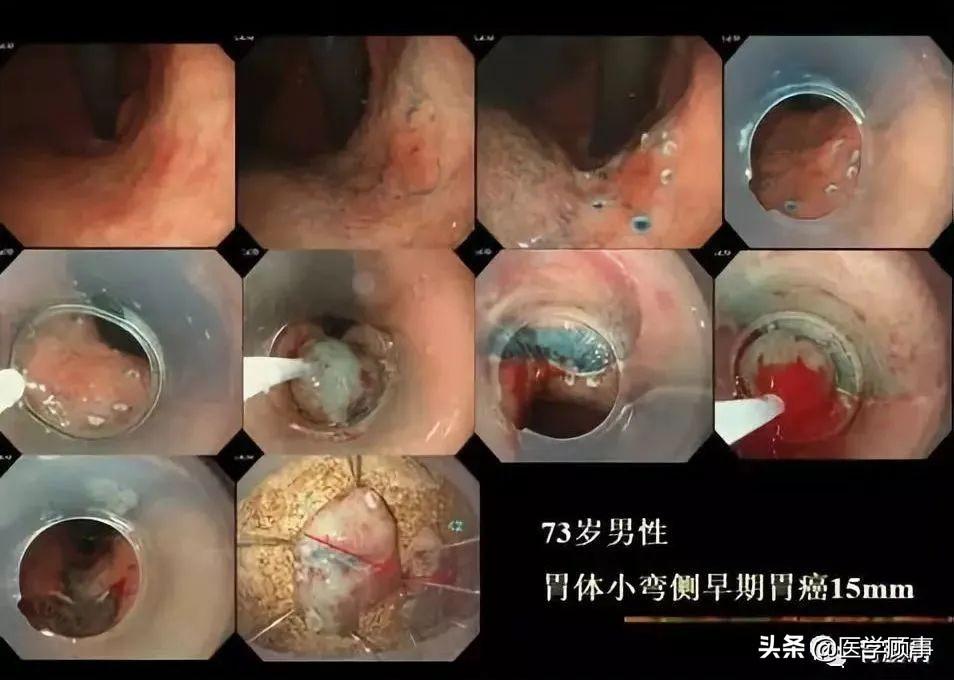
2. 胃肠道早癌
ESD治疗消化道早期肿瘤的适应证为淋巴结转移,无论病灶位置及大小如何,均能应用ESD切除。在日本,ESD已被确立为上消化道早期肿瘤内镜切除的标准方法。
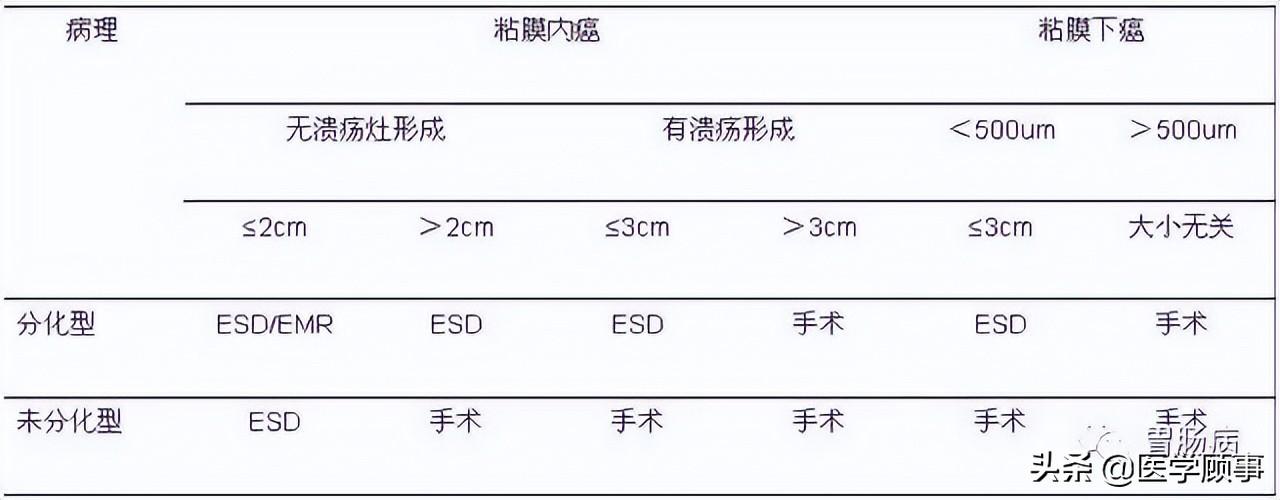
目前 ESD 治疗早期胃癌适应证为:
(1)分化型黏膜内癌、无溃疡发生;
(2)溃疡、分化型黏膜内癌,病变直径<30mm;
(3)sm1浸润分化型腺癌,无溃疡发生,无淋巴即血行转移,病变直径小于30mm;
(4)低分化型黏膜内癌,无溃疡发生,病变直径<20mm。
对于年老体弱,有手术禁忌证或疑有淋巴结转移的黏膜下癌可视为相对适应证。
3. 消化道黏膜下肿瘤
消化道黏膜下肿瘤(SML)是指一大类消化道上皮以下组织起源的实体肿瘤,包括平滑肌瘤、间质瘤、脂肪瘤、神经源性肿瘤、类癌、异位胰腺、囊肿、静脉瘤等,对于直径>2 cm的黏膜下隆起需ESD治疗。
表1 胃癌ESD治疗的适应证

上图:食管病变ESD适应证
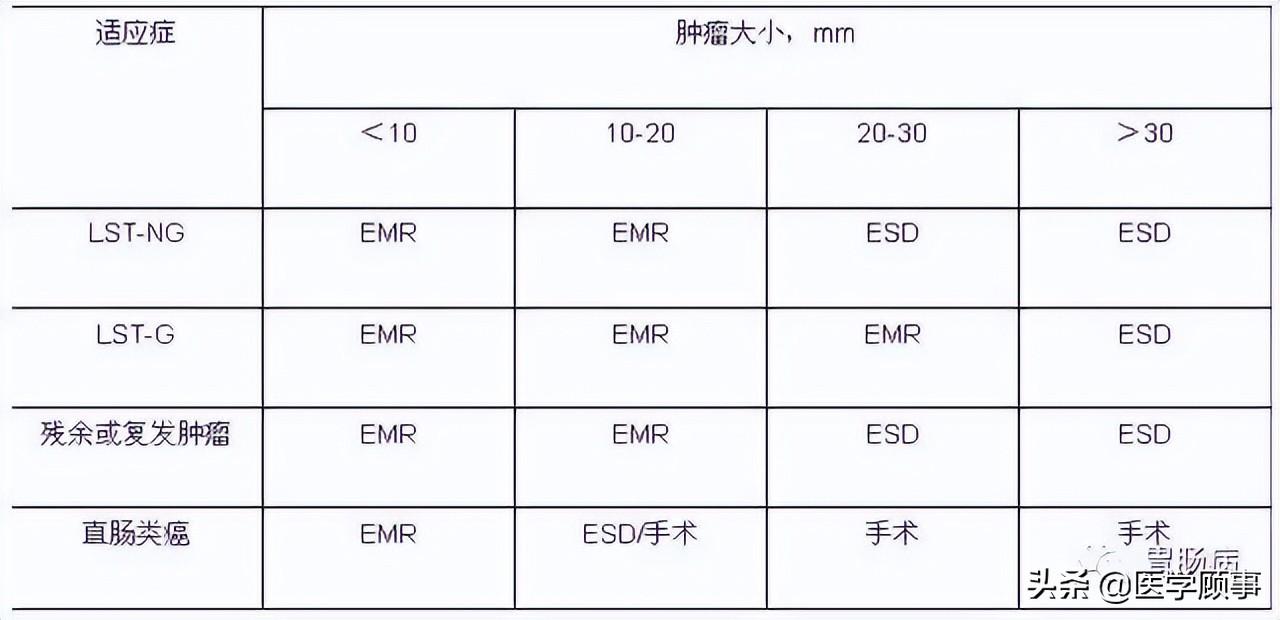
表2 结直肠病变 ESD 适应证

三、ESD的禁忌证
1.病变隆起试验阴性(基底部注射生理盐水后局部无明显隆起),提示病变基底部的黏膜下层与基层间有粘连,肿瘤可能已浸润至肌层组织。
2.心脏、大血管手术术后服用抗凝剂、血液病、凝血功能障碍者,在凝血功能没有得到纠正前,严禁ESD治疗。
3. ESD在肿瘤剥离过程中技术难度高,耗时较长,清醒状态下患者难以耐受,手术过程中上消化道的分泌物及胃腔内血性液体、染色剂等易造成患者呛咳、误吸、窒息等。手术在全麻、气管插管的状态下进行较为安全。

四、ESD的准备
1.ESD的常用物品
常用物品:
消化道治疗内镜、高频电发生器、针式切开刀、末端绝缘手术刀(IT刀)、钩形电刀、圈套器、透明帽、热活检钳、氩气刀、金属钛夹、注水泵等。
常用的黏膜下注射液有:
生理盐水、20%葡萄糖溶液、甘油果糖、生理盐水稀释四倍的透明质酸盐、甘油稀释四倍的透明质酸盐、纤维蛋白原、1:200000肾上腺素以及1:20000靛胭脂等。
2.ESD的术前准备
- 掌握无痛内镜的适应证及禁忌证,详细询问患者的年龄,有无心肺疾患及高血压病史,了解药物过敏史,进行必要的术前检查:血常规、凝血功能、血生化、心电图、胸片等常规检查。
-
- 应积极与患者及家属进行有效的沟通,将无痛内镜下ESD的目的、治疗过程、安全性及其优越性告知,减轻和消除患者的恐惧心理,介绍成功的病例,稳定情绪,积极配合治疗。
-
- 嘱患者前一晚进清淡、易消化食物,术前12h禁食。

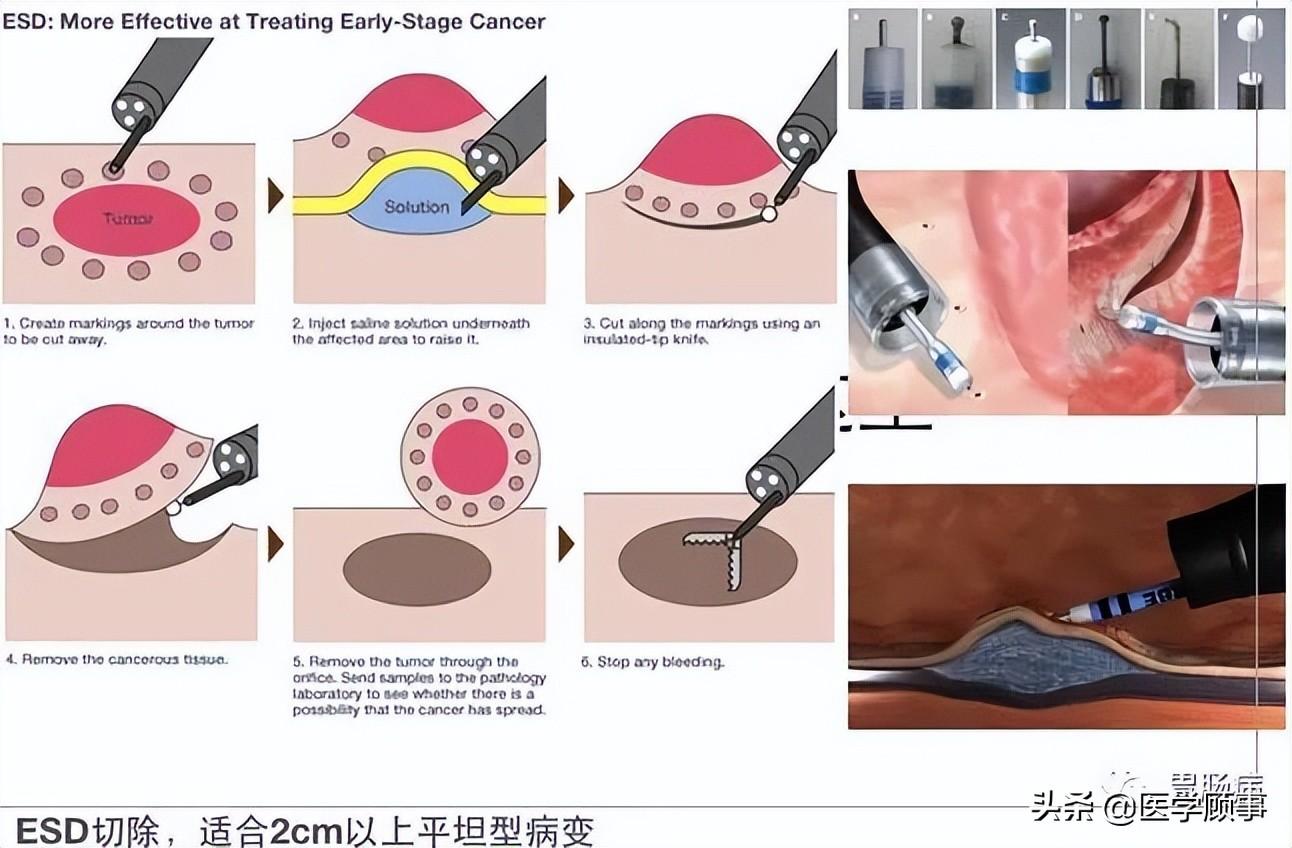
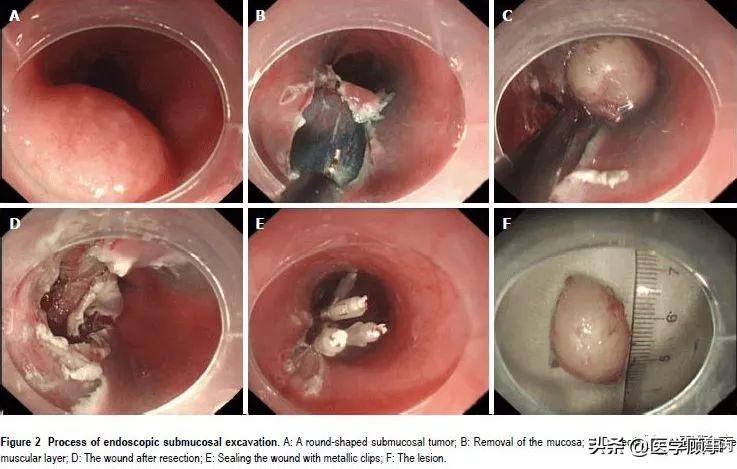
五、ESD的基本步骤
基本步骤如下图所示:
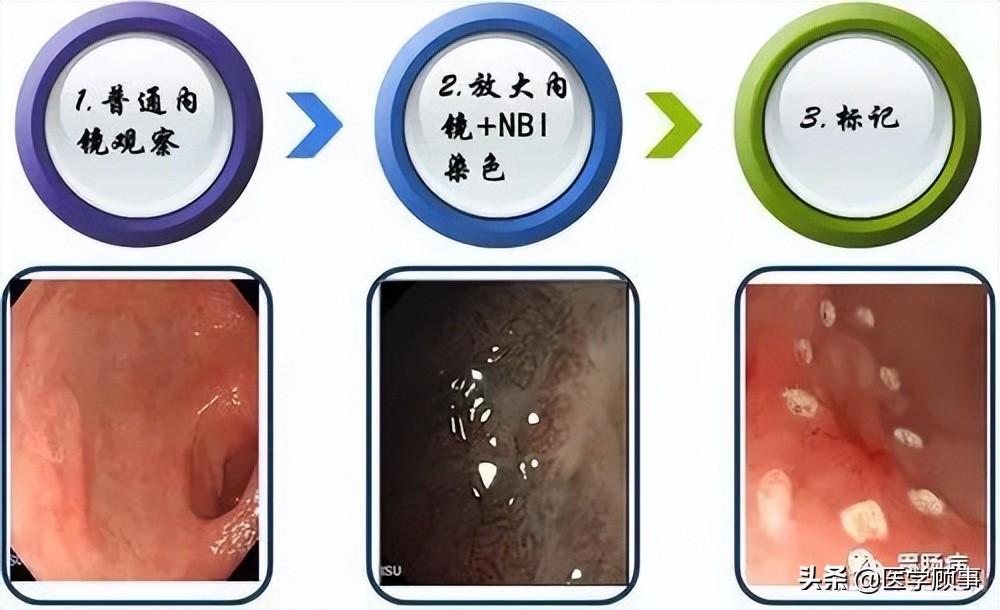
下面详细讲解:
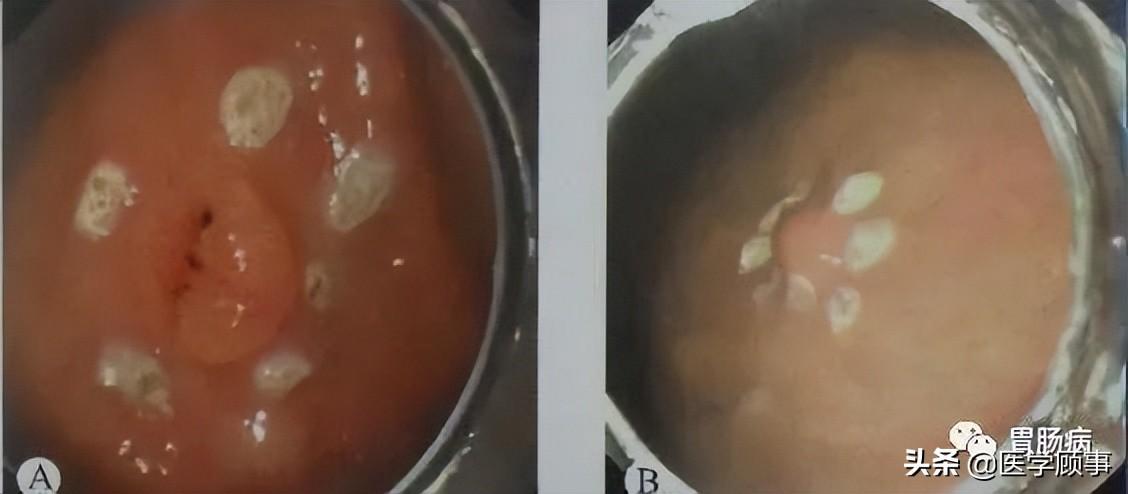
1.标记:
应用针形切开刀或APC于病灶边缘0.5~1.0cm进行电凝标记。
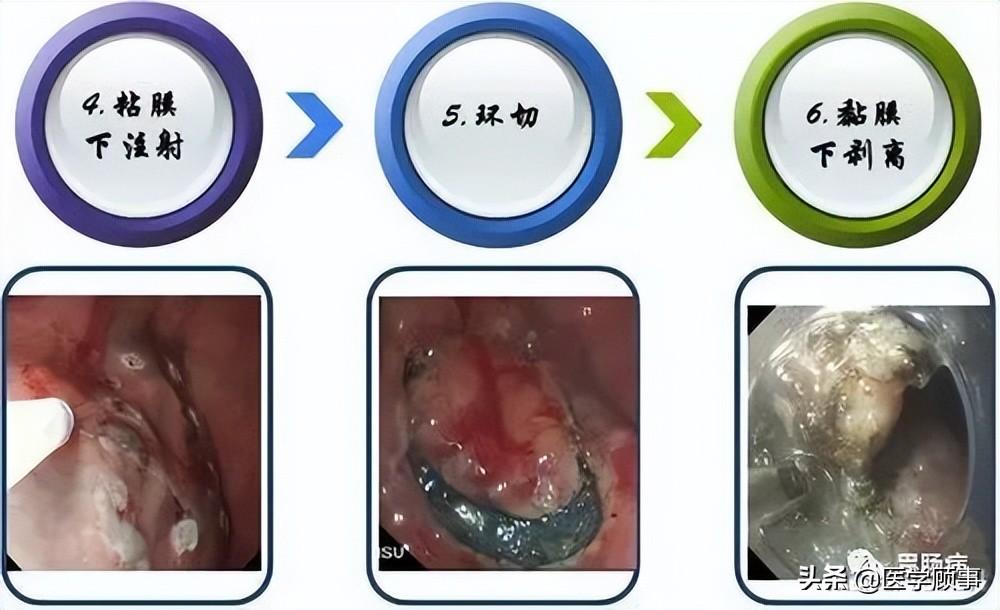
2.抬起:
于病灶边缘标记点外侧进行多点黏膜下注射,每点约2ml,可重复注射,直至病变明显抬起。上消化道黏膜下注射原则先肛侧后口侧,下消化道黏膜下注射先口侧后肛侧。
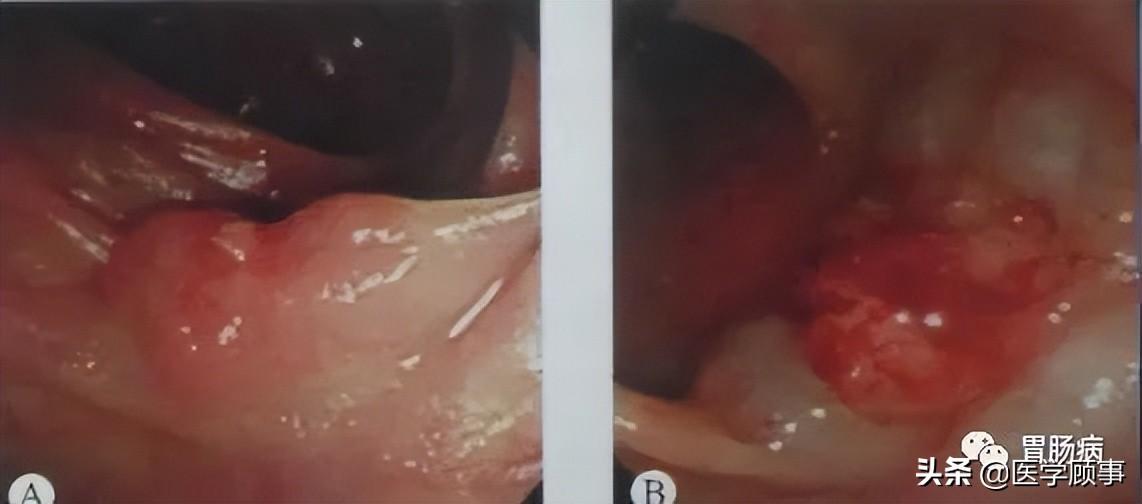
3.切缘:
应用针形切开刀、HOOK刀、IT刀沿病灶边缘标记点切开黏膜。缘切开时会引起出血。一旦出血要及时处理,可用治疗器械电凝止血或热活检钳电凝止血;边缘切开过深时,会造成切开部位穿孔,可应用金属夹夹闭,不必终止ESD治疗。
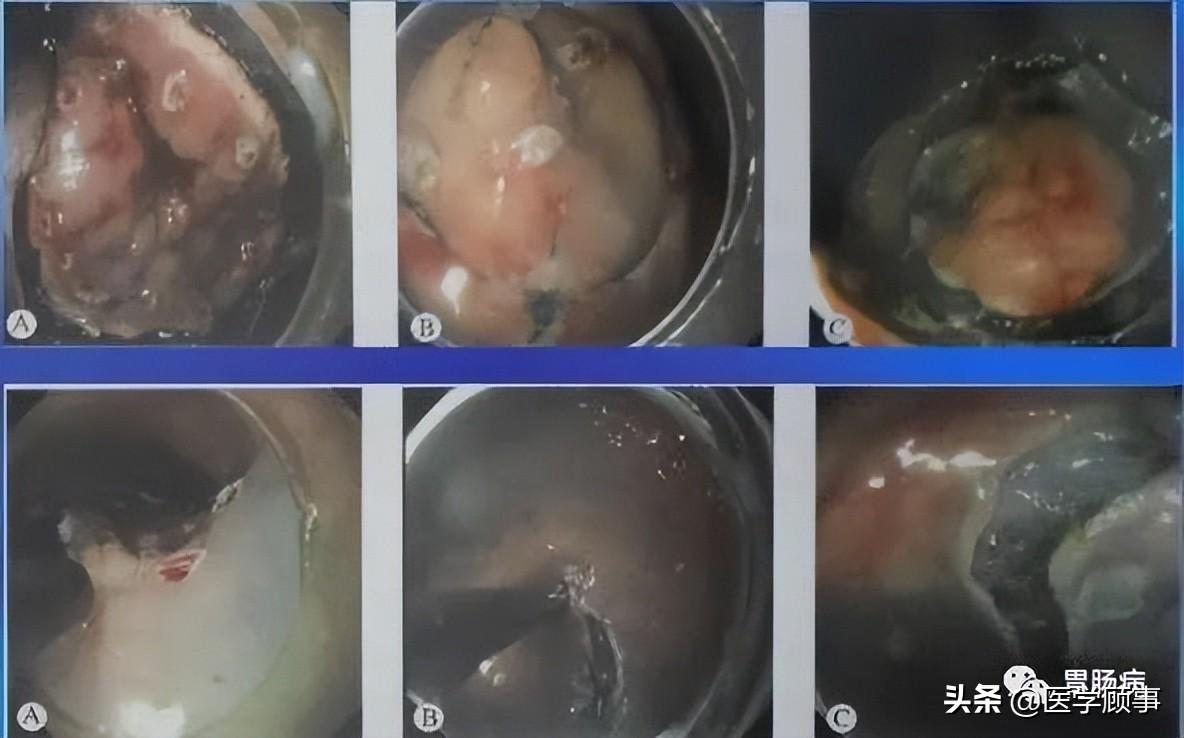
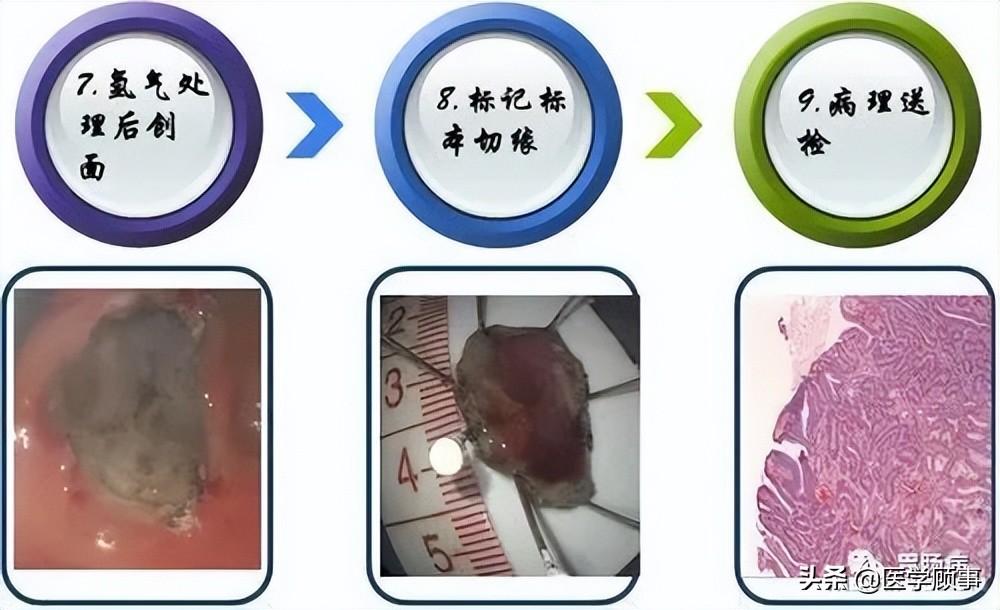
4.剥离:
应用IT刀或HOOK刀沿切缘对病变黏膜下层进行剥离,切除病变以大头针固定后送病理检验。
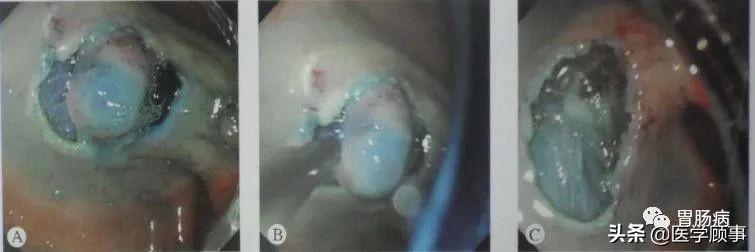
5.创面处理:
完整剥离病灶后要对创面进行处理,对出血点要进行止血:
面积较大或侵犯层次较深的创面,要应用金属夹夹闭,防止术后穿孔的发生。
- 患者术后严格禁食,给予抑酸、抗炎、止血和保护黏膜等药物,逐步开放饮食。
-
- 一般经过8周的质子泵抑制剂治疗,术后较大的创面基本能愈合。
-
- 术后定期内镜随访可了解创面愈合程度及病灶有无复发等情况。

六、ESD的并发症及其处理
1.出血
出血多发生在术中或术后24h内,操作中黏膜下反复足够注射有助于预防ESD术中出血;剥离过程中,少量渗血可直接用0.9%NaCl溶液或2%冰去甲肾上腺素溶液冲洗,微小的出血可通过电凝治疗,大血管选用热活检钳烧灼,必要时可使用金属夹进行夹闭治疗。
在ESD术后应对创面所有裸露的小血管进行处理,必要时金属夹夹闭创面,在创面处理时应特别注意,尤其是位于固有肌层病变,切除后残余的肌层非常薄,使用APC对创面血管进行电凝时易造成穿孔。现不主张以APC方式进行创面血管的处理。
术后常规应用质子泵抑制剂(静脉点滴)3d,可有效降低迟发型出血的概率,口服8周,可促进溃疡面的愈合。
2.穿孔
较小的穿孔可采用金属夹夹闭并留置胃管观察,穿孔较大内镜不能闭合创面,或同时合并出血,应及时中转腹腔镜修补穿孔创面。
内镜下金属夹夹闭后的穿孔,经内科保守治疗,如胃肠减压、禁食水和PPI治疗后愈合,极少数较大穿孔需外科手术治疗。避免术中发生消化道穿孔最重要的一点是在ESD术中始终保持操作视野清晰。
3.狭窄
狭窄形成主要是食管ESD后的并发症,也可能见于胃贲门及幽门前区ESD术后。
切除病灶的面积及周长与狭窄形成的风险高低有关。食管环周ESD术后的狭窄发生率接近100%。ESD术后导致的狭窄可通过应用激素以预防,治疗可通过食管扩张。

七、ESD的术后护理
1.做好患者复苏护理,做好交接班;
2.病理标本及时送检;
3.嘱患者严格卧床休息24h,避免大幅度活动,观察有无发热、心悸、冷汗、腹痛、便血等感染及出血并发症;
4.术后禁食48~72h,然后改为温凉流质(米汤、面汤\牛奶等),逐渐过渡到半流质饮食(软面条、粥等),禁食粗糙辛辣食物,半个月内避免重体力活动,出血且创面较大患者延长禁食时间,遵医嘱给予营养、抗感染、制酸药物应用;
5.ESD术中使用的金属夹会随着创面的愈合而自行脱落排出,做好患者解释,消除患者顾虑。手术创面会形成溃疡,一般1~2个月后完全愈合,嘱患者定期复查随访内镜。
6.术后病理为高级别上皮内瘤变、黏膜内癌、黏膜下层浅层癌有局部残留及复发风险需密切随访。间隔3个月、6个月、12个月、1年、1年、1年共6次随访,必要时追加腹部增强CT,如有局部复发可以及时内镜下切除!

八、患者须知事项

